
标题:血脂水平与脑微出血的关系:一项针对自发性脑出血患者的研究解读
1. 研究主题的领域相关进展
血脂管理是心脑血管疾病一级和二级预防的基石。目前的临床指南普遍推荐,对于高风险人群应使用最大耐受剂量的降脂药物(主要是他汀类),以强效降低低密度脂蛋白胆固醇(LDL-C)水平,从而减少动脉粥样硬化性心血管疾病(如缺血性卒中)的风险。然而,临床实践中一个长期存在的争议是:过低的胆固醇水平是否会增加脑出血(Intracerebral Hemorrhage, ICH)的风险?
这一争议源于多项大型流行病学研究和临床试验的观察结果。一些研究发现,极低的LDL-C水平与ICH风险的增加存在关联,提示在降脂治疗中可能存在一个“J型曲线”效应,即过度降低胆固醇可能弊大于利,尤其是在出血风险方面。这使得临床医生在为患者(尤其是有出血倾向的患者)制定降脂目标时,常常面临平衡缺血与出血风险的两难境地。
脑微出血(Cerebral Microbleeds, CMBs)作为一种重要的神经影像学标志物,为我们理解这一问题提供了新的视角。CMBs是在磁敏感加权成像(SWI)或梯度回波(GRE)T2*序列上表现为直径2-10毫米点状低信号的陈旧性微小出血灶,被认为是脑内小血管病变和血管脆性增加的“活体证据”。大量研究证实,CMBs的存在,特别是多发性CMBs,是未来发生症状性ICH的独立危险因素。因此,通过研究与CMBs相关的可控性危险因素,可能为预防未来ICH事件提供新的靶点。
近年来,多项研究开始探索血脂水平与CMBs之间的关系,但主要集中在普通人群、缺血性卒中患者或认知障碍患者中,结论尚不统一。部分研究提示,较低的总胆固醇(TC)或LDL-C水平与CMBs(尤其是脑叶型CMBs)的发生风险增加有关。然而,专门针对已经发生过ICH的患者群体,系统探究其血脂谱与CMBs特征(特别是不同部位的CMBs)关系的研究相对匮乏。这一特定人群是预防ICH复发的最高危人群,阐明他们体内血脂与血管脆性标志物(CMBs)的关系,对于指导其后续的降脂治疗策略具有极为重要的临床意义。
2. 研究背景和目的
本研究的背景,正是聚焦于上述临床实践中的核心矛盾与知识空白。对于已经经历过一次自发性ICH的患者,他们未来卒中复发的风险极高,其中既包括缺血性事件,也包括再次出血。临床医生迫切需要知道,对此类患者进行降脂治疗是否安全?降脂的“度”应该如何把握?
现有的知识缺口在于,我们对于ICH患者体内血脂水平与脑微出血(这一预示着再出血风险的影像学标志物)之间的具体关系知之甚少。例如,是哪一种血脂成分(TC, LDL-C, HDL-C, TG, or Non-HDL-C)与CMBs的关联最密切?这种关联是否存在部位特异性(脑叶型 vs. 深部型 vs. 幕下型)?阐明这些问题,将为ICH患者的个体化血脂管理提供关键的循证依据。
因此,本研究的核心目的被清晰地定义为:
通过一项回顾性队列研究,系统性地分析自发性ICH患者入院时的血脂谱特征,并探究不同血脂参数与脑微出血(CMBs)的存在及其不同解剖位置分布之间的关联性。
3. 研究方法简介
这是一项基于北京天坛医院前瞻性、常规收集的自发性ICH队列数据的回顾性、观察性研究。
· 研究设计与参与者:
o 设计:回顾性队列研究。
o 参与者:研究连续纳入了2014年1月至2016年8月期间入院的223名自发性ICH患者。
o 纳入标准:年龄≥18岁;经头颅CT确诊为ICH;具有完整的CMBs影像信息和血脂检测数据。
o 排除标准:继发性ICH(如外伤、肿瘤、血管畸形等所致)、原发性脑室内出血、或在MRI检查前接受了外科手术干预。
· 数据收集:
o 临床与人口学信息:通过电子病历系统收集患者的年龄、性别、体重指数(BMI)、吸烟饮酒史、既往病史(高血压、糖尿病等)以及入院时的格拉斯哥昏迷评分(GCS)、NIHSS评分、血肿体积和位置等。
o 实验室检查:记录患者入院次日清晨空腹(>8小时)采集的静脉血样本检测结果,重点关注血脂谱,包括总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)以及非高密度脂蛋白(Non-HDL)。
o 影像学分析:由两名对临床数据设盲的神经科医生独立评估所有患者入院6天内完成的头颅MRI,重点在磁敏感加权成像(SWI)序列上识别CMBs的存在、数量和位置。根据公认标准,将CMBs分为脑叶型(lobar)、深部型(deep)和幕下型(infratentorial)三类。
· 统计学分析:
o 使用适当的统计方法(t检验、卡方检验等)比较有无CMBs(以及不同位置CMBs)的患者组间基线特征的差异。
o 采用多变量logistic回归模型,在校正了年龄、高血压史等潜在混杂因素后,分析各个血脂参数(TC, LDL, Non-HDL等)与脑叶型CMBs存在之间的独立关联性,并计算比值比(OR)和95%置信区间(CI)。
4. 研究结果和解读
本研究共纳入223名自发性ICH患者,平均年龄55岁,其中73.1%为男性。在这些患者中,111人(49.8%)被检测出存在CMBs。研究的核心发现揭示了血脂水平与特定位置CMBs之间的显著负相关关系。
基线特征分析
在对不同CMBs位置的患者进行分组比较时,发现了一些关键差异:
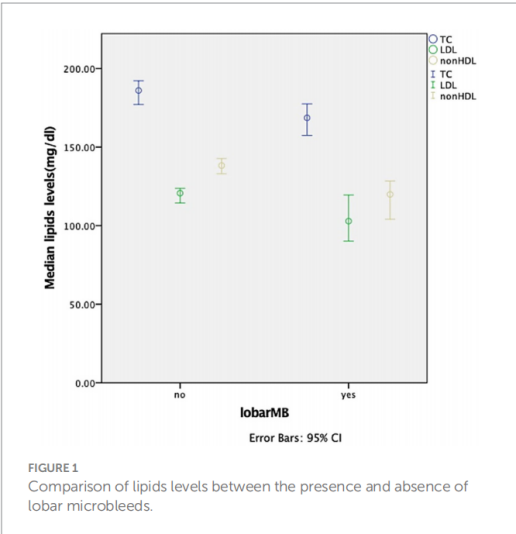
· 脑叶型CMBs:与没有脑叶型CMBs的患者相比,有脑叶型CMBs的患者年龄更大(61岁 vs. 55岁, p=0.006),高血压病史更普遍(85.4% vs. 69.2%, p=0.037)。最重要的是,在单变量分析中,有脑叶型CMBs的患者,其血清总胆固醇(TC)、低密度脂蛋白(LDL)和非高密度脂蛋白(Non-HDL)水平均显著更低。
· 深部型CMBs:与没有深部型CMBs的患者相比,有深部型CMBs的患者高血压病史更普遍,并且更常有饮酒史。但两组间的血脂水平均无显著差异。
表1:脑叶型CMBs患者与非脑叶型CMBs患者的血脂水平比较
血脂参数 | 无脑叶型CMBs组 (N=182) | 有脑叶型CMBs组 (N=41) | P值 |
TC (mg/dL) | 186.01 (158.06 - 215.01) | 168.60 (149.85 - 192.77) | 0.012 |
LDL (mg/dL) | 120.65 (95.61 - 143.66) | 102.86 (85.46 - 129.93) | 0.026 |
Non-HDL (mg/dL) | 138.25 (109.82 - 161.83) | 119.88 (102.29 - 141.54) | 0.006 |
注:数值表示为中位数(四分位距)。 |
多变量回归分析
为了排除混杂因素的干扰,研究者进行了多变量logistic回归分析,以确定血脂参数与脑叶型CMBs的独立关联。
表2:血脂水平对脑叶型微出血的多变量校正OR值
血脂参数 | 校正后OR (95% CI) | P值 |
TC | 0.989 (0.979 - 0.999) | 0.028 |
LDL | 0.991 (0.980 - 1.001) | 0.089 |
Non-HDL | 0.989 (0.979 - 1.000) | 0.043 |
注:校正了年龄和高血压病史。 |
核心解读:
回归分析的结果是本研究最关键的发现。在校正了年龄和高血压这两个最重要的影响因素后:
1. 总胆固醇(TC)和非高密度脂蛋白(Non-HDL)水平与脑叶型CMBs的存在呈显著的独立负相关。具体来说,TC或Non-HDL每升高1 mg/dL,出现脑叶型CMBs的几率就降低约1.1%。这表明,在ICH患者中,较低的TC和Non-HDL水平是脑叶型CMBs的一个独立危险因素。
2. 低密度脂蛋白(LDL)水平在校正后与脑叶型CMBs的关联失去了统计学显著性(p=0.089),尽管仍表现出负相关的趋势。这可能与样本量有关,也可能提示Non-HDL(包含了LDL、VLDL等所有致动脉粥样硬化性脂蛋白)作为一个更全面的指标,与血管病变的关联性更强。
3. 研究未发现任何血脂参数与深部型或幕下型CMBs存在显著关联,提示低血脂与CMBs的关联具有明显的部位特异性。
这一发现的临床意义重大,因为它指向了不同类型脑小血管病的病理生理差异。脑叶型CMBs通常与脑淀粉样血管病(Cerebral Amyloid Angiopathy, CAA)有关,而深部型CMBs则主要与高血压性小动脉硬化相关。本研究的结果提示,低胆固醇可能主要影响与CAA相关的血管病变过程,导致血管脆性增加和微出血,而对高血压性小动脉硬化的影响则不明显。
5. 讨论与展望
本研究在ICH这一特殊人群中,为低血脂水平与脑叶型CMBs之间的关联提供了新的、直接的证据,引发了对ICH患者血脂管理策略的深刻思考。
研究的亮点与临床意义
1. 聚焦于高危人群:本研究首次在自发性ICH患者这一预防复发的关键人群中,系统探究了血脂与CMBs的关系,填补了重要的知识空白,其结论对临床实践具有直接的指导价值。
2. 揭示了关联的部位特异性:研究明确指出了低TC和低Non-HDL水平主要与“脑叶型”CMBs相关,而与深部/幕下型无关。这一发现极具启发性,它不仅支持了不同部位CMBs具有不同病理基础的理论,更提示我们,在评估ICH患者的降脂风险时,需要关注其CMBs的分布模式。对于以脑叶型CMBs为主(提示可能存在CAA)的患者,过度降低胆固醇可能需要格外谨慎。
3. 强调了Non-HDL的重要性:研究发现Non-HDL是比LDL更稳健的预测因子,这与许多心血管领域的研究结论一致,提示在神经血管疾病的风险评估中,也应更多地关注Non-HDL这一综合性指标。
研究的不足与批判性评述
1. 回顾性设计的局限性:作为一项回顾性研究,无法确定血脂水平与CMBs之间的因果关系和时间顺序。低血脂是导致CMBs的原因,还是仅仅是某种潜在病理状态(如CAA)的伴随标志,尚无法断定。
2. 样本量与人群偏倚:研究的样本量相对较小(223例),且为单中心研究,人群以中国汉族为主。这可能导致结果存在一定的选择偏倚,例如,研究中他汀使用率较低(9%),使得分析他汀与CMBs关系的效能不足。结论是否能推广到其他种族人群,需要进一步验证。
3. 缺乏CAA的病理证实:尽管脑叶型CMBs强烈提示CAA,但本研究缺乏脑脊液生物标志物或病理学的最终证实,这使得关于病理机制的推论仍停留在假说层面。
对未来的展望
基于本研究的发现和局限,未来的研究应在以下几个方面深入推进:
1. 开展大规模前瞻性队列研究:亟需设计大型前瞻性研究,长期随访ICH患者,动态监测其血脂水平变化、他汀类药物的使用情况以及CMBs的演变(新发或增多),以明确低血脂及降脂治疗与CMBs进展的因果关系。
2. 结合生物标志物进行精准分型:未来的研究应结合脑脊液Aβ40/42检测、APOE4基因分型等生物标志物,对ICH患者进行更精准的病因分型(CAA vs. 高血压性血管病),从而在更纯粹的人群中探究血脂与CMBs的关系。
3. 探索最佳降脂目标:最终的研究目标是回答临床核心问题:对于不同病因、不同CMBs负担的ICH幸存者,其最佳的血脂控制目标究竟是多少?未来的随机对照试验需要探索不同的降脂强度对缺血和出血事件净获益的影响,从而为制定真正个体化的ICH二级预防指南提供最高等级的证据。
总而言之,这篇研究虽为回顾性,但其发现“在ICH患者中,低TC和低Non-HDL水平与脑叶型CMBs独立相关”,如同一块重要的拼图,为我们理解“降脂与出血”这一复杂关系提供了关键线索。它警示我们,在追求降低缺血风险的同时,必须警惕过度降脂可能带来的出血风险,尤其是在那些影像学上已显示出脑叶型血管脆性证据的患者中。
 0
0


