
标题:多维数据驱动的药物重用策略:一项筛选缺血性卒中神经保护剂的创新研究解读
1. 研究主题的领域相关进展
缺血性卒中(Ischemic Stroke, IS)是由于脑部血管阻塞导致血流中断,从而引发神经功能损伤的重大疾病,是全球范围内导致死亡和长期残疾的首要原因。尽管溶栓和取栓等血运重建治疗取得了一定的成功,但其严格的时间窗限制和出血风险使其应用受限。因此,开发能够在缺血再灌注损伤过程中保护神经元的神经保护剂,一直是卒中治疗研究的核心目标。然而,在过去的几十年里,数百种在临床前研究中显示出巨大潜力的神经保护药物,在进入临床试验后几乎都以失败告终。
这种转化困境的原因是多方面的,包括对神经保护概念的误解(如过分关注单一靶点)、临床前模型与人类病理生理的差异,以及卒中病理过程的极端复杂性。近年来,随着“神经血管单元”概念的提出,研究者们认识到神经保护不应仅局限于神经元本身,而应涵盖包括胶质细胞、血管内皮细胞等在内的整个微环境。
与此同时,药物重用(Drug Repurposing),即“老药新用”,作为一种创新的药物开发策略,因其能显著缩短研发周期、降低成本和减少未知风险而备受青睐。随着高通量测序技术和生物信息学的飞速发展,利用计算机和人工智能算法,从海量的生物医学大数据中系统性地筛选和预测已有药物的新用途,已成为药物发现的前沿领域。特别是在神经系统疾病这样复杂的领域,传统的药物研发模式步履维艰,计算药物重用策略展现出巨大的潜力。然而,现有的许多计算策略往往依赖于单一维度的信息(如仅基于基因组学或化学结构),未能充分整合疾病复杂的多维病理信息,从而限制了筛选的准确性和效率。
2. 研究背景和目的
本研究的背景,正是立足于卒中神经保护药物研发的长期困境与计算药物重用策略的巨大机遇之上。研究者们敏锐地意识到,要提高神经保护剂筛选的成功率,必须打破传统单一信息源的局限,构建一个能够整合多维度生物信息的、更智能的筛选平台。
现有的知识缺口在于,缺乏一种能够同时整合疾病基因表达谱(反映疾病状态)和已知药物神经保护活性数据(反映药效特征)的系统性计算药物重用策略。如何将这两个看似独立却又内在关联的数据维度有效地结合起来,并通过机器学习算法进行高效筛选,是一个亟待解决的技术难题。
因此,本研究的核心目的被清晰地定义为:
1. 开发并验证一种全新的多维数据驱动的计算药物重用策略(Multidimensional Data-Driven Computational Drug Repurposing strategy, MDCDR)。
2. 应用这一策略,从美国FDA批准的药物库中,系统性地筛选具有治疗缺血性卒中潜力的新型神经保护剂。
3. 对筛选出的候选药物进行系统的体外和体内实验验证,阐明其神经保护效果和潜在的作用机制。
4. 最终,通过这一创新研究范式,为缺血性卒中的神经保护治疗发现新的候选药物和药物靶点。
3. 研究方法简介
这是一项典型的“干湿结合”研究,巧妙地融合了尖端的计算生物学方法和严谨的实验生物学验证。其核心是创新的MDCDR策略。
· MDCDR策略的核心流程:
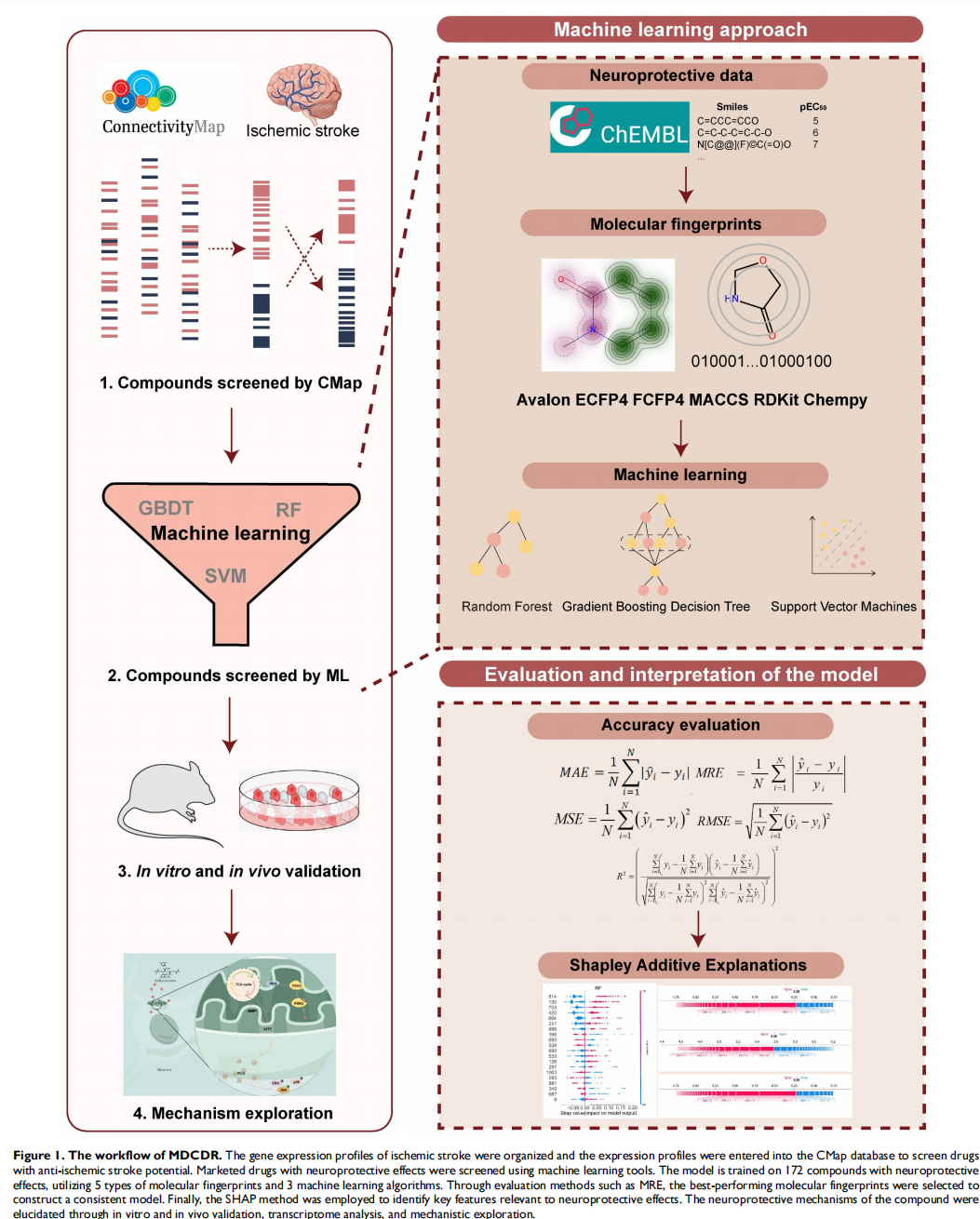
模块一:基于疾病基因组学的候选药物初筛
§ 数据来源:从GEO数据库获取三个大型缺血性卒中相关的微阵列数据集(GSE16561, GSE58294, GSE22255),共包含百余例患者和对照样本。
§ 分析方法:通过生物信息学分析,筛选出在卒中患者脑组织中稳定上调和下调的差异表达基因(DEGs)。
§ 药物预测:将这些差异基因列表输入到**Connectivity Map (CMap)**数据库中。CMap是一个大型药物基因组学数据库,它记录了数千种小分子化合物处理细胞后引起的基因表达变化。通过计算卒中基因特征与药物诱导的基因特征之间的“反向关联”,可以预测出哪些药物可能逆转卒中引起的病理基因表达变化,从而初步筛选出具有潜在治疗效果的候选药物。
1. 模块二:基于机器学习的神经保护活性精准筛选
§ 构建预测模型:研究者建立了一个神经保护活性预测模型(Neuroprotection Activity Prediction Model, NPAPM)。
§ 训练数据:从ChEMBL数据库中收集了172个已被实验证实对SH-SY5Y神经母细胞瘤细胞具有神经保护作用的化合物及其活性数据(EC50值)。
§ 模型构建:将这172个化合物的化学结构转化为多种类型的“分子指纹”(一种描述分子结构的数字化编码)。然后,分别使用三种强大的机器学习算法——随机森林(RF)、支持向量机(SVM)和梯度提升决策树(GBDT)——来训练模型,让机器学会从分子结构预测其神经保护活性的强弱。
§ 精准筛选:将模块一中初筛出的候选药物输入到训练好的NPAPM模型中,预测它们各自的神经保护活性。只有那些被模型预测为具有强神经保护活性的药物,才会被选为最终的候选药物。
· 实验验证:
o 体外验证:将最终筛选出的19种候选化合物,在氧糖剥夺/复糖复氧(OGD/R)诱导的SH-SY5Y细胞损伤模型(一种模拟脑缺血再灌注损伤的经典细胞模型)中进行测试,验证它们是否能真实地提高神经细胞的存活率。
o 体内验证:将体外验证中效果最显著的药物——舒布硫胺(Sulbutiamine, SUL)——在大鼠大脑中动脉闭塞/再灌注(MCAO/R)模型(一种模拟人类缺血性卒中的金标准动物模型)中进行验证。评估指标包括大鼠的存活率、神经功能缺损评分、脑梗死体积、脑含水量以及神经元丢失情况等。
o 机制探索:通过RNA测序、药物亲和反应靶点稳定性(DARTS)、细胞热转移(CETSA)、表面等离子共振(SPR)等一系列高精尖的分子生物学技术,深入探究SUL发挥神经保护作用的具体分子靶点和信号通路。
4. 研究结果和解读
本研究通过创新的MDCDR策略,成功筛选并验证了一种具有显著神经保护作用的老药,并揭示了其全新的作用机制。
计算筛选结果
· 通过MDCDR策略,研究团队从数千种药物中,最终筛选出19种具有高度潜力的候选神经保护剂。
· 对这19种药物进行体外细胞实验验证,发现包括阿托伐他汀、氯吡格雷在内的10种药物在10µM浓度下能显著提高OGD/R损伤后神经细胞的存活率。
· 在进一步的筛选和综合评估(包括毒性、成本、血脑屏障通透性等)后,**舒布硫胺(Sulbutiamine, SUL)**因其在两种细胞模型(OGD/R和H₂O₂诱导的氧化应激模型)中均表现出优异的保护效果而被选为最终的研究对象。值得一提的是,氯吡格雷和长春西汀等临床已用于卒中治疗的药物也在筛选之列,这从侧面印证了该筛选策略的有效性。
舒布硫胺(SUL)的体内外药效验证
· 体内药效:在MCAO/R大鼠模型中,口服SUL能够:
o 显著提高卒中后大鼠的7日存活率。
o 显著降低神经功能缺损评分,改善运动协调能力。
o 通过MRI和TTC染色证实,SUL能显著减小脑梗死体积和脑水肿。
o 通过免疫荧光染色证实,SUL能显著减少缺血半暗带区域的神经元丢失和细胞凋亡。
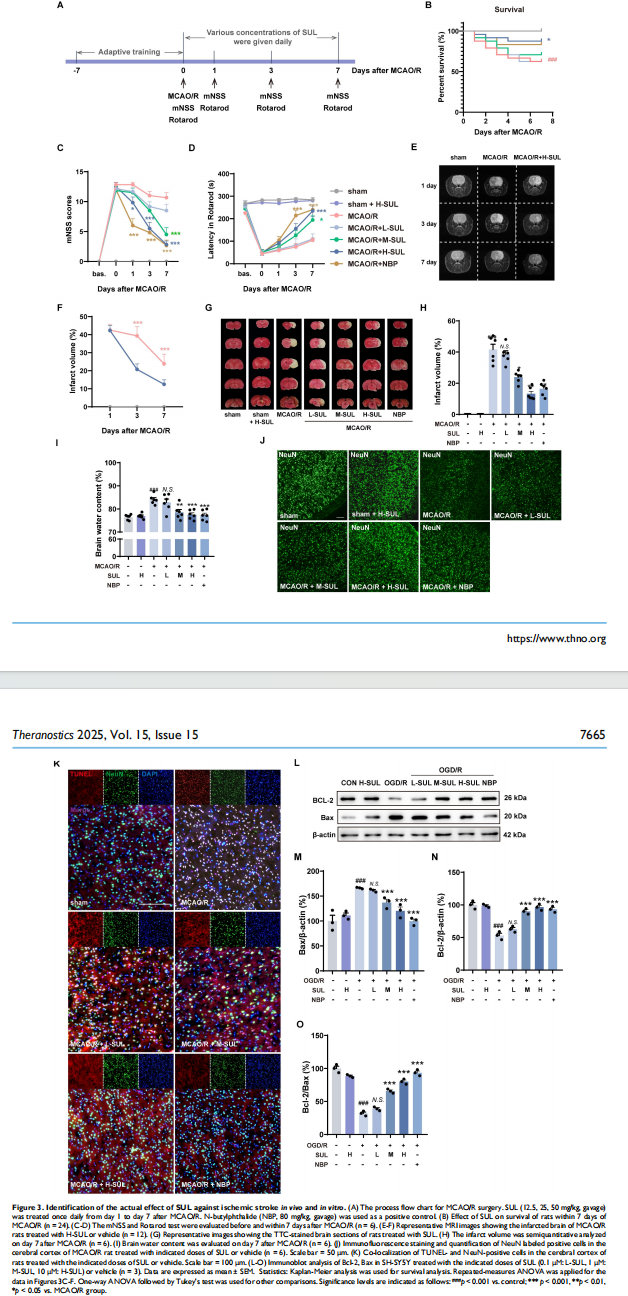
· 体外药效:在OGD/R细胞模型中,SUL能够显著抑制神经细胞的凋亡,表现为抗凋亡蛋白Bcl-2上调,促凋亡蛋白Bax下调。
作用机制的革命性发现:靶向PDK2
这是本研究最令人兴奋的部分。通过一系列精密的机制探索实验,研究者揭示了一个前所未知的SUL作用通路:
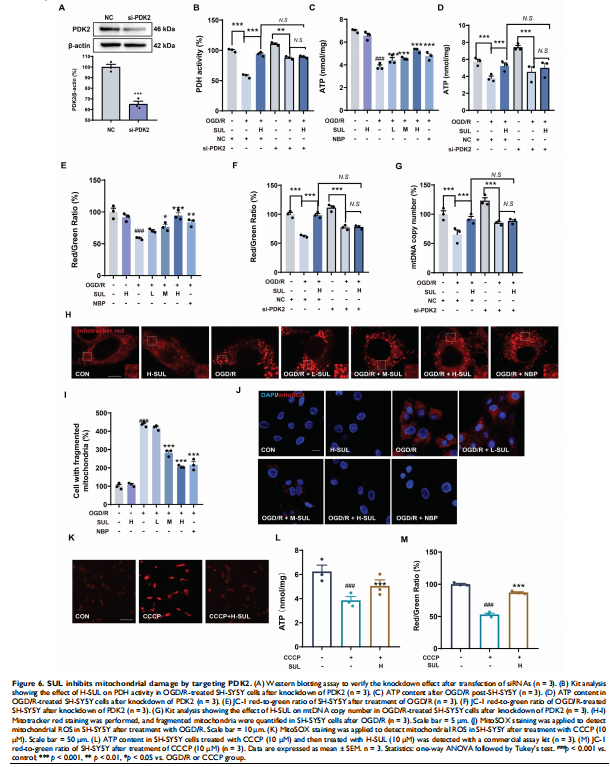
1. 锁定靶点:通过转录组学分析、激酶抑制谱预测以及细胞热转移(CETSA)、药物亲和(DARTS)等靶点验证技术,研究者惊奇地发现,SUL可以直接与一个关键的代谢酶——丙酮酸脱氢酶激酶2(Pyruvate Dehydrogenase Kinase 2, PDK2)——结合。
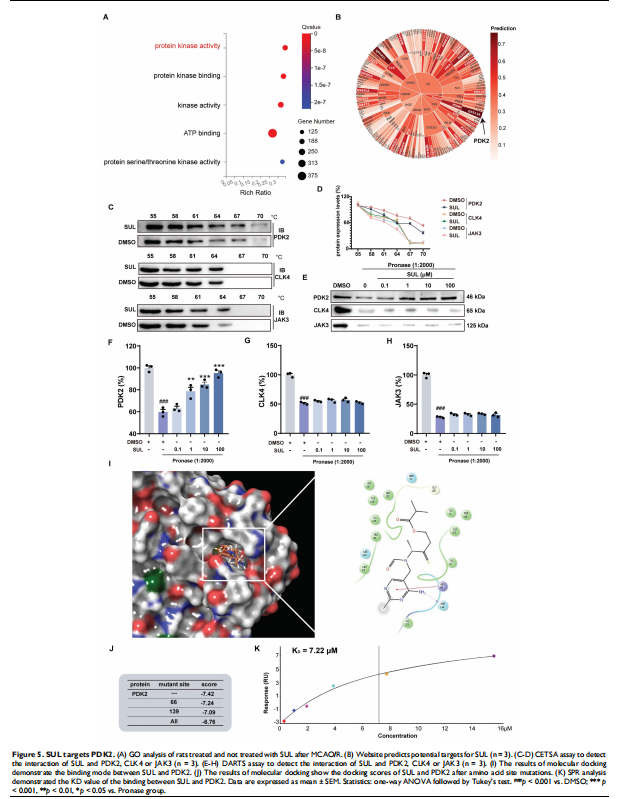
2. 功能验证:PDK2是线粒体能量代谢的“刹车片”,其功能是抑制丙酮酸脱氢酶(PDH)的活性,从而阻碍葡萄糖氧化。实验证实,SUL通过抑制PDK2,相当于“松开”了线粒体代谢的刹车,从而:
o 增强了PDH的活性。
o 改善了线粒体功能,增加了ATP的产生,稳定了线粒体膜电位。
o 显著减少了线粒体来源的活性氧(ROS)的产生,从而减轻了氧化应激。
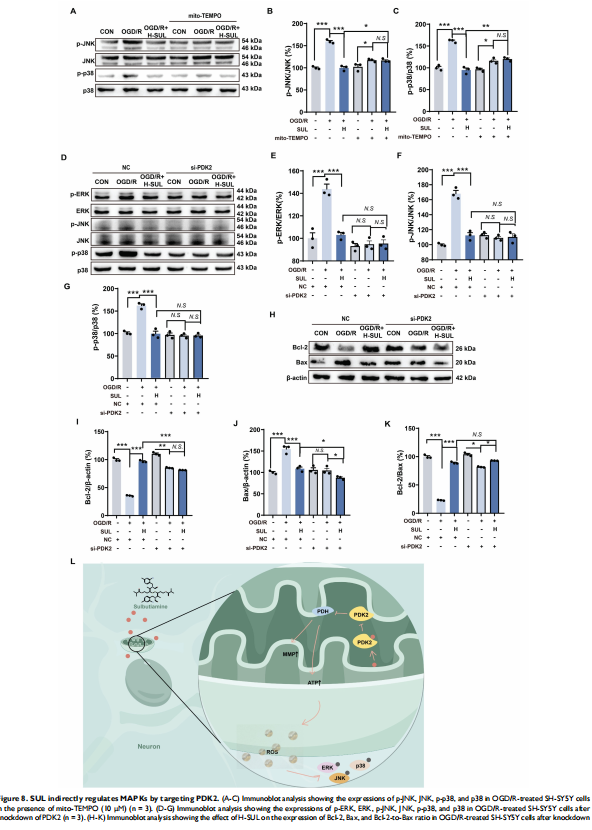
3. 通路解析:过量的ROS是激活细胞凋亡信号通路(如MAPK通路)的关键上游事件。实验证实,SUL正是通过“抑制PDK2 → 改善线粒体功能 → 减少ROS产生”这一系列上游事件,最终抑制了MAPK信号通路的过度激活,从而减少了神经元的凋亡。
4. 因果关系确认:在通过siRNA技术敲低了细胞中的PDK2后,SUL的上述所有保护作用(包括改善线粒体功能、减少ROS、抑制MAPK通路和抗凋亡)均被显著削弱甚至消除。这为“SUL通过靶向PDK2发挥神经保护作用”提供了坚实的因果链证据。
5. 讨论与展望
这项研究不仅成功开发了一种高效的计算药物重用策略,还发现了一种具有巨大潜力的新型神经保护剂,并为其找到了一个全新的药物靶点,其科学价值和临床转化前景均十分广阔。
研究的亮点与临床意义
1. 创新的MDCDR策略:本研究最大的亮点是其原创的MDCDR策略。它巧妙地将反映疾病状态的“基因语言”(转录组学)与反映药物效应的“化学语言”(分子指纹+机器学习)相结合,实现了从“宏观病理”到“微观药效”的跨维度筛选,显著提高了筛选的精准度和效率。这一策略本身就是一个可推广的方法学平台,可用于其他复杂疾病的药物发现。
2. 发现SUL的全新神经保护作用:SUL是一种人工合成的硫胺素(维生素B1)衍生物,临床上曾用于治疗乏力等症状。本研究首次系统性地证实了其在缺血性卒中中的强大神经保护作用,为这一“老药”赋予了全新的临床应用潜力。其良好的血脑屏障通透性和已知的安全性,使其成为一个极具吸引力的卒中治疗候选药物。
3. 揭示PDK2作为卒中治疗新靶点:本研究不仅找到了“药”,更找到了“靶”。研究首次将PDK2确定为SUL的直接作用靶点,并阐明了“抑制PDK2-改善线粒体代谢-抗氧化-抗凋亡”这一全新的神经保护通路。这不仅解释了SUL的作用机制,更重要的是,它将PDK2这一关键代谢调控酶推向了卒中药物研发的前台,使其成为一个极具前景的全新药物靶点。
研究的不足与批判性评述
1. 计算模型的局限性:尽管MDCDR策略表现优异,但其依赖的公共数据库本身可能存在偏倚,机器学习模型的预测能力也受限于训练数据集的大小和质量。
2. 实验模型的局限性:本研究的体内验证仅使用了健康青年雄性大鼠模型,未能涵盖老年、雌性或伴有高血压、糖尿病等合并症的动物模型,而这些模型更能模拟真实的临床患者情况。
3. 临床转化仍需验证:虽然SUL展现了巨大的潜力,但其在人体内的最佳治疗剂量、时间窗以及与溶栓/取栓治疗联合应用的效果,仍需通过严格的临床试验来最终确定。
对未来的展望
本研究为卒中神经保护领域开辟了令人兴奋的新方向:
1. MDCDR策略的广泛应用:该策略可以被应用于筛选针对其他神经退行性疾病(如阿尔茨海默病、帕金森病)的候选药物,有望加速整个神经科学领域的药物发现进程。
2. SUL的临床转化研究:应尽快启动SUL治疗缺血性卒中的临床前安全性评价和I期临床试验,探索其在人类患者中的应用潜力。
3. 基于PDK2靶点的新药研发:基于本研究揭示的SUL与PDK2的结合模式,可以利用药物化学的方法设计和合成选择性更高、活性更强的PDK2抑制剂,从而开发出全新的、拥有自主知识产权的神经保护药物。
总而言之,这篇研究是计算生物学与实验医学完美结合的典范。它不仅为我们带来了一个潜在的卒中治疗新药,更重要的是,它提供了一种创新的研究范式和一个全新的药物靶点,为在神经保护这一充满挑战的领域取得突破带来了新的曙光。
 0
0



