
标题:fNIRS在卒中后抑郁神经机制研究中的应用:一项关于额颞叶皮层激活与功能连接异常的文献解读
1. 研究主题的领域相关进展
卒中后抑郁(Post-stroke depression, PSD)是脑卒中最常见的神经精神并发症之一,影响约三分之一的卒中幸存者。PSD不仅严重影响患者的情绪和生活质量,更重要的是,它会显著阻碍神经功能的恢复进程,降低康复治疗的积极性和效果,最终导致更差的预后。目前,临床上对PSD的诊断主要依赖于汉密尔顿抑郁量表(HAMD)等评估工具,但这些量表具有明显的主观性,其评估结果易受患者的失语、认知障碍以及检查者的主观判断等多种因素干扰,从而影响诊断的准确性。因此,寻找能够客观反映PSD病理生理变化的生物学标志物,对于实现早期、精准诊断和个体化治疗至关重要。
随着神经影像学技术的发展,研究者们得以在宏观网络层面探索精神疾病的神经生物学机制。功能性磁共振成像(fMRI)作为脑功能研究的“金标准”,已为揭示PSD的神经环路异常提供了重要线索。然而,fMRI设备昂贵、对环境要求高(需屏蔽、低噪音)、空间密闭且对头动极为敏感,限制了其在临床,尤其是行动不便的卒中患者中的广泛应用。
相比之下,功能性近红外光谱技术(functional near-infrared spectroscopy, fNIRS)作为一种新兴的、非侵入性的脑功能成像工具,近年来在精神病学领域展现出巨大的应用潜力。fNIRS通过测量头皮下大脑皮层血红蛋白浓度(特别是氧合血红蛋白HbO)的变化,来间接反映神经元的活动水平。它兼具较高的时间和空间分辨率,且设备便携、成本低、抗运动干扰能力强、无电离辐射,使其非常适合用于卒中等特殊患者群体的床旁或康复过程中的动态监测。大量研究已证实,fNIRS在辅助诊断抑郁症、精神分裂症、焦虑症等多种精神障碍,乃至预测治疗反应和追踪病程方面具有重要价值。
在抑郁症的研究中,前额叶皮层(prefrontal cortex, PFC)被认为是情绪调节网络的核心节点。多数fNIRS研究发现,抑郁症患者在执行认知任务时,PFC特别是背外侧前额叶皮层(dorsolateral prefrontal cortex, DLPFC)的激活水平普遍降低。然而,关于激活模式的具体脑区、激活减低的程度与抑郁严重程度的关系,以及不同抑郁亚型(如轻、中、重度)之间是否存在差异,目前尚无统一结论。此外,大脑是一个高度连接的复杂网络,单一脑区的激活异常不足以完全解释复杂的精神症状。因此,分析脑区之间的功能连接(functional connectivity, FC)——即不同脑区神经活动在时间上的同步性——能更全面地揭示大脑网络功能的重组与失调。目前,针对PSD功能连接的研究多集中于静息态,而任务态下的网络特征,尤其是在不同抑郁严重程度的患者中如何变化,仍有待深入探索。
2. 研究背景和目的
本研究的背景立足于当前PSD诊疗面临的核心挑战:缺乏客观的诊断生物标志物,以及对不同严重程度PSD的神经病理机制理解不足。尽管fNIRS技术结合语言流畅性任务(Verbal Fluency Task, VFT)——一种能有效激活PFC的认知范式——已被证实有助于抑郁症的辅助诊断,但卒中患者大脑血流动力学激活和功能连接的模式,及其与抑郁严重程度的具体关联,尚未被充分阐明。
现有的知识缺口主要在于:卒中后,随着抑郁症状从无到有、从轻到重,其大脑额颞叶皮层的功能活动(激活)和网络协作(连接)是如何动态演变的?这种变化是否存在一种“剂量依赖”关系?这些神经影像学特征是否能作为区分不同程度PSD的潜在标志物?
基于此,本研究的核心目的有以下两点:
1. 利用VFT-fNIRS范式,探究不同抑郁严重程度(无抑郁、轻度抑郁、中度抑郁)的卒中患者在执行认知任务时,其额颞叶皮层脑区激活和功能连接的特征差异。
2. 通过分析这些影像学特征与HAMD抑郁评分的相关性,揭示PSD严重程度与大脑功能重组之间的关系,为理解PSD的神经病理机制提供客观证据,并为未来发展基于fNIRS的PSD分级诊断和个体化治疗提供理论基础。研究团队的核心假设是:不同抑郁水平的卒中患者,其额颞叶的激活模式和功能连接特征存在显著差异,且这些差异可以通过fNIRS技术被量化和可视化。
3. 研究方法简介
本研究是一项在中国临床试验中心注册的横断面临床试验,旨在比较不同程度PSD患者在任务态下的脑功能差异。
· 研究设计与参与者:研究共招募了56名卒中患者,均来自温州中医院。纳入标准包括:经MRI/CT确诊的单侧大脑半球卒中(病程1-12个月)、年龄30-80岁、简易精神状态检查(MMSE)得分≥20分、右利手等。排除标准包括:病情危重、严重交流障碍(如失语)、颅骨修补术后、重度抑郁(HAMD-17 > 24分)以及卒中前已患有抑郁症等。根据17项汉密尔顿抑郁量表(HAMD-17)的评分,将所有参与者分为三个组:无PSD组(non-PSD, n=18, HAMD ≤ 7分)、轻度PSD组(mild-PSD, n=19, HAMD 8-17分)和中度PSD组(moderate-PSD, n=19, HAMD 18-24分)。
· 干预措施(任务范式):所有参与者均需完成一项语言流畅性任务(VFT)。该任务分为三个阶段:准备阶段(30秒,反复念数字1-5)、任务阶段(60秒,分为三个20秒的小节,分别要求参与者说出以“白”、“北”、“大”开头的词语)、以及休息阶段(70秒,反复念数字1-5)。
· 主要测量指标:
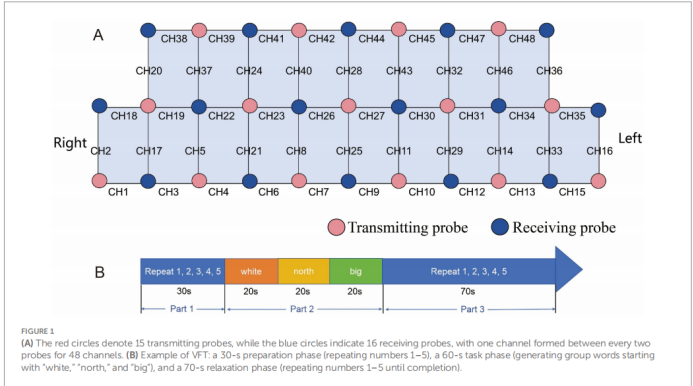
1. 脑激活水平:使用多通道fNIRS系统(Nirsmart-6000BS)实时监测大脑额颞叶皮层的血流动力学变化。该系统包含15个发射探头和16个接收探头,共形成48个测量通道。本研究主要分析与神经活动密切相关的氧合血红蛋白(Oxy-Hb)浓度的变化值作为脑激活的指标。
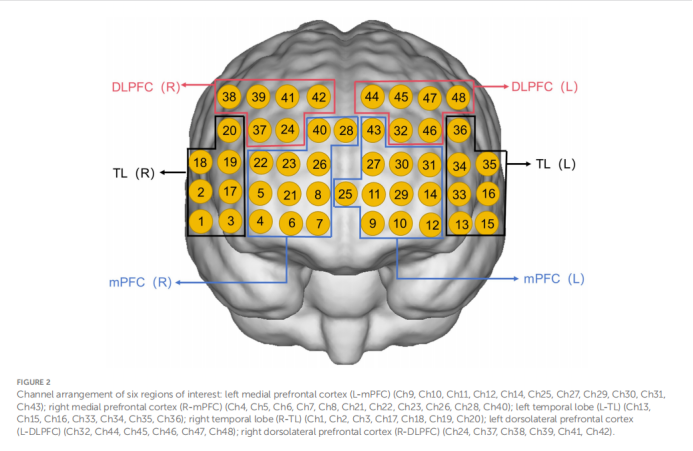
2. 功能连接:将48个通道根据布罗德曼分区划分为6个感兴趣区域(Regions of Interest, ROIs):左/右背外侧前额叶皮层(L/R-DLPFC)、左/右内侧前额叶皮层(L/R-mPFC)和左/右颞叶(L/R-TL)。通过计算不同ROI之间Oxy-Hb时间序列的皮尔逊相关系数,来衡量它们之间的功能连接强度。
3. 临床评估:使用HAMD-17评估抑郁严重程度,MMSE评估总体认知功能。
4. 研究结果和解读
本研究的核心发现在于揭示了随着PSD严重程度加深,大脑额颞叶皮层呈现出“激活降低”与“连接增强”并存的复杂神经调节模式。
基线数据
三组患者在年龄、性别、受教育年限、卒中类型、病程、患病半球以及VFT任务表现(生成词语数量)等方面均无统计学差异,这保证了组间比较的可靠性。唯一的显著差异在于HAMD-17评分,符合分组设计预期。
表1:受试者人口统计学与临床信息
特征 | 无PSD组 (n=18) | 轻度PSD组 (n=19) | 中度PSD组 (n=19) | 统计值 (X²/F/H) | p值 |
年龄 (岁) | 53.50 (20.25) | 65 (24) | 70 (18) | 4.649 | 0.098 |
性别 [N(%)] | 1.635 | 0.442 | |||
男性 | 12 (66.7%) | 9 (47.4%) | 12 (63.2%) | ||
女性 | 6 (33.3%) | 10 (52.6%) | 7 (36.8%) | ||
受教育年限 | 5.5 (7.25) | 9 (6) | 6 (8) | 5.293 | 0.0715 |
卒中类型 [N(%)] | 0.065 | 0.968 | |||
缺血性 | 12 (66.7%) | 12 (63.2%) | 12 (63.2%) | ||
出血性 | 6 (33.3%) | 7 (36.8%) | 7 (36.8%) | ||
发病时间 (天) | 60 (92) | 30 (40) | 30 (100) | 1.787 | 0.409 |
卒中部位 [N(%)] | 0.500 | 0.779 | |||
皮层 | 6 (33.3%) | 7 (36.8%) | 5 (26.3%) | ||
皮层下 | 12 (66.7%) | 12 (63.2%) | 14 (73.7%) | ||
病变半球 [N(%)] | 4.401 | 0.111 | |||
左侧 | 11 (61.1%) | 6 (31.6%) | 6 (31.6%) | ||
右侧 | 7 (38.9%) | 13 (68.4%) | 13 (68.4%) | ||
生成词语数量 | 5.56 ± 2.57 | 5.68 ± 2.70 | 4.68 ± 3.48 | 0.643 | 0.530 |
MMSE评分 | 25 (5) | 28 (5) | 26 (5) | 0.580 | 0.748 |
HAMD-17评分 | 4 (4) | 9 (4) | 18 (2) | 49.741 | <0.001 |
注:数值表示为中位数(四分位距),平均值±标准差,或频数(%)。 |
脑激活结果与解读
在执行VFT任务时,三组患者的额颞叶激活模式表现出明显差异。
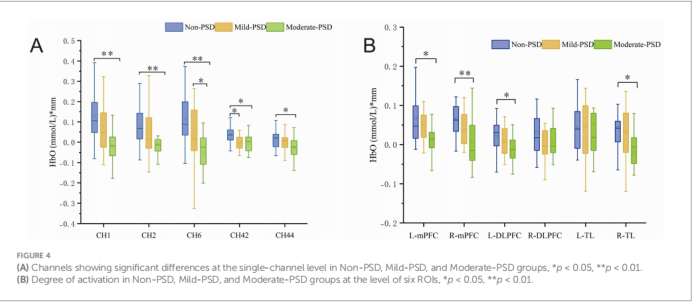
· 总体趋势:从激活热图可以看出,中度PSD组的整体额颞叶激活水平均低于轻度PSD组和无PSD组,呈现出一种随抑郁严重程度增加而激活减弱的“剂量效应”。
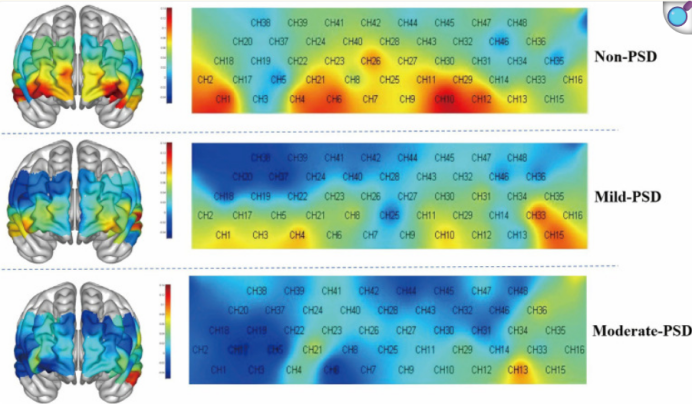
· 关键脑区激活:与无PSD组相比,中度PSD组在多个脑区的激活水平均显著降低,这些脑区包括双侧内侧前额叶皮层(mPFC)、患侧背外侧前额叶皮层(DLPFC)以及健侧颞叶(TL)。而轻度PSD组仅在健侧DLPFC的一个通道(CH42)上表现出激活减弱。
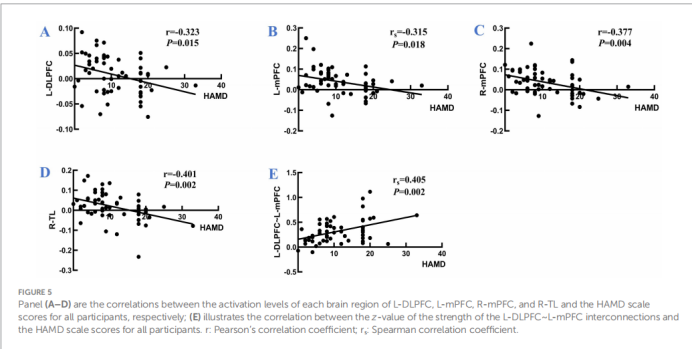
· 与抑郁评分的相关性:在所有受试者中,上述激活减弱脑区(L-DLPFC, L-mPFC, R-mPFC, R-TL)的激活水平均与HAMD-17评分呈显著负相关。即抑郁症状越严重,这些关键脑区的神经活动水平越低。
表2:关键脑区激活差异总结
比较组别 | 显著激活降低的脑区 | 与HAMD-17评分相关性 |
中度PSD vs. 无PSD | 双侧mPFC, 患侧DLPFC, 健侧TL | 显著负相关 (r值在-0.315到-0.401之间, p < 0.05) |
轻度PSD vs. 无PSD | 健侧DLPFC (仅CH42) | 不显著 |
中度PSD vs. 轻度PSD | 健侧mPFC (仅CH6) | 不显著 |
功能连接结果与解读
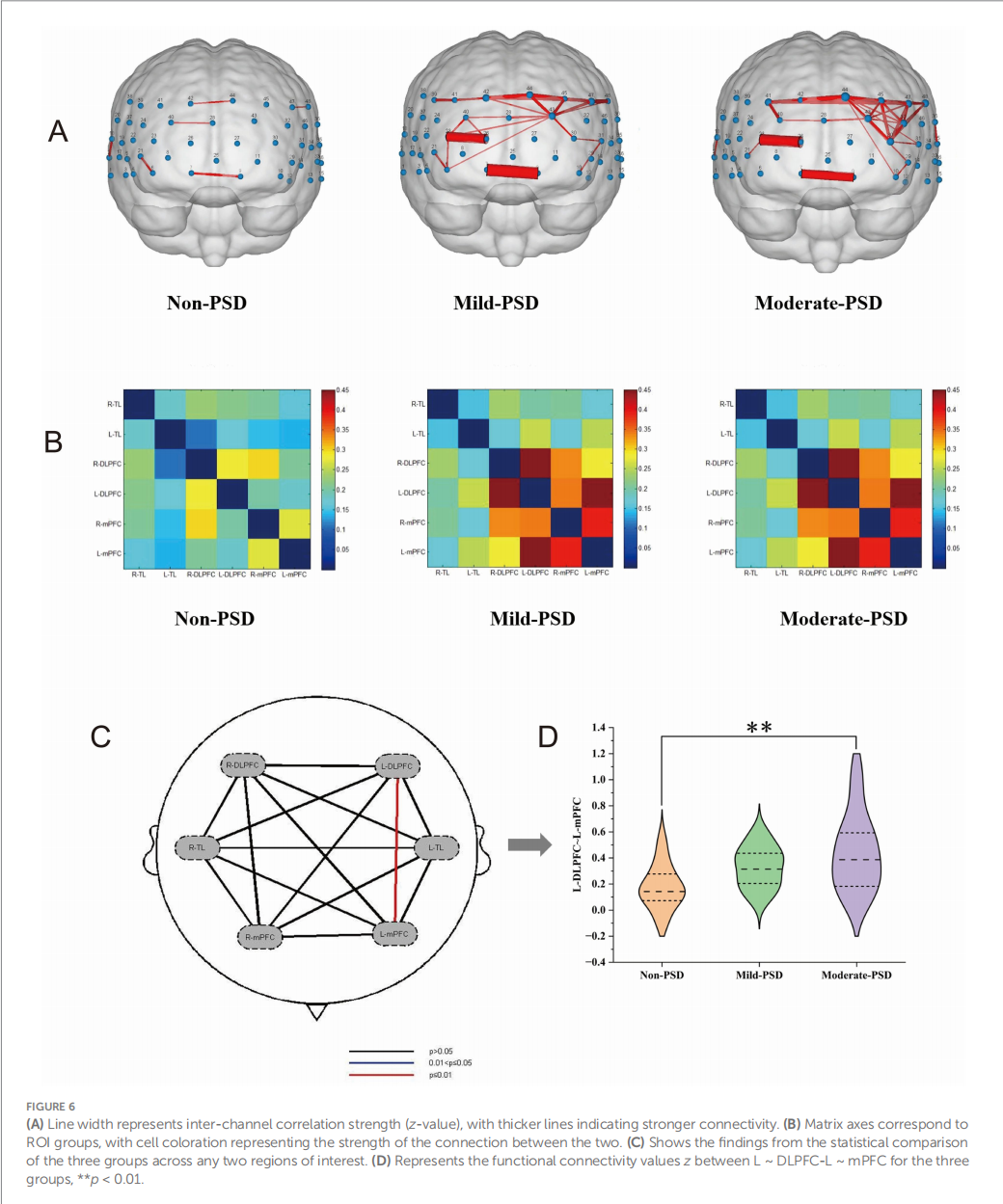
与脑激活模式相反,功能连接在抑郁组中表现出异常增强。
· 连接模式:结果显示,与无PSD组相比,轻度和中度PSD组的额颞叶局部功能连接强度显著增强,尤其是在DLPFC与mPFC之间。
· 关键连接:在患侧半球,DLPFC与mPFC之间的功能连接强度在中度PSD组中显著高于无PSD组。
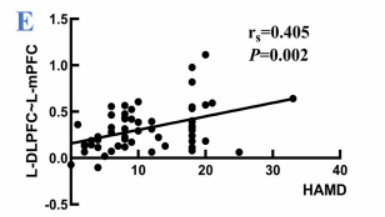
· 与抑郁评分的相关性:最关键的发现是,患侧DLPFC-mPFC之间的功能连接强度与HAMD-17评分呈显著正相关(r = 0.405, p = 0.002)。这意味着,抑郁症状越重,这两个核心情绪和认知调控脑区之间的功能耦合反而越强。
与卒中部位的关联
为了探究观测到的功能变化是否与卒中病灶的解剖位置(皮层 vs. 皮层下)有关,研究者进行了相关性分析。结果显示,无论是脑激活水平、功能连接强度,还是HAMD-17抑郁评分,均与卒中病灶的深浅位置无显著相关性(所有p > 0.05)。这一发现提示,PSD的神经机制可能更多地依赖于大脑网络功能的动态重组,而非特定局部结构损伤的直接后果。
结果解读:
综合来看,本研究揭示了PSD病理生理的一个核心矛盾现象:功能减退(激活降低)与代偿失调(连接增强)并存。随着抑郁加重,大脑关键认知和情绪调节区域(如DLPFC、mPFC)无法被有效激活以应对任务需求,这可能是PSD患者认知执行功能受损和情绪调节障碍的直接神经基础。然而,为了弥补这种功能不足,大脑网络内部可能发生了异常的、过度的功能耦合,表现为DLPFC-mPFC连接的病理性增强。这种“超同步化”可能并非一种有效的代偿,反而可能是一种功能失调的表现,反映了神经环路的僵化和效率低下,导致了持续的抑郁状态。
5. 讨论与展望
本研究利用VFT-fNIRS范式,成功描绘了不同严重程度PSD患者额颞叶皮层功能重组的图景,其结果具有重要的临床和科研价值,同时也存在一些局限性,为未来的研究提供了方向。
研究的亮点
1. 揭示了PSD的“分级”神经病理模式:本研究最大的亮点在于,它没有将PSD视为一个单一的整体,而是通过分层比较,发现了一个从轻度到中度抑郁的渐进性功能改变模式。研究结果支持一种“代偿-失代偿”模型:在轻度抑郁阶段,大脑功能损害尚局限,网络可能仍在尝试代偿;而到了中度抑郁阶段,广泛的脑区激活减退和关键环路连接异常增强,表明神经调节系统进入“失代偿”状态。这为理解PSD的疾病进展提供了新的视角。
2. 发现了“低激活-高连接”的矛盾现象:本研究同时考察了脑激活和功能连接,并发现两者呈现相反的变化趋势,这是一个深刻的发现。它提示我们,PSD的神经机制并非简单的功能抑制,而是一种复杂的网络重组障碍。这种“低效高耗”的网络模式可能正是维持抑郁症状的核心环路基础,也解释了为何PSD患者常感到“心有余而力不足”。
3. 为fNIRS的临床应用提供了有力证据:本研究证实,fNIRS能够捕捉到与PSD严重程度相关的客观神经信号变化,且这些信号(如患侧DLPFC-mPFC连接强度)与临床量表评分显著相关。这表明fNIRS有潜力成为一种辅助临床诊断、量化抑郁严重程度、甚至监测治疗反应的客观工具。亚组分析还初步提示,这种神经标志物在不同卒中类型(如出血性卒中)中可能表现更敏感。
研究的不足与批判性评述
1. 样本量较小与横断面设计:本研究的样本量相对较小(每组约19人),这可能限制了结果的统计效力和普适性,尤其是在轻度PSD组中未能发现更多显著差异,可能与此有关。此外,横断面设计无法揭示因果关系和病程的动态演变,我们无法确定观察到的功能异常是抑郁的原因还是结果。
2. 潜在的混杂因素:尽管研究控制了多个人口学和临床变量,但仍有一些潜在的混杂因素未能完全排除,例如卒中病灶的具体体积、患者用药史、以及更细微的认知功能差异等,这些都可能对大脑功能产生影响。
3. fNIRS技术的固有局限:fNIRS的探测深度有限,主要监测大脑皮层表面的活动,无法探测到与情绪密切相关的深部核团(如杏仁核、丘脑)的活动。因此,本研究描绘的只是PSD神经环路异常的一部分。
对未来的展望
基于本研究的发现和不足,未来的研究方向可以聚焦于以下几点:
1. 开展大规模纵向研究:需要更大样本量的纵向研究,从卒中急性期开始,持续追踪患者的fNIRS信号和情绪变化,以明确额颞叶功能异常与PSD发生发展的时序关系和预测价值。
2. 多模态影像融合:将fNIRS与能够提供高空间分辨率(如fMRI)或高时间分辨率(如EEG)的技术相结合,实现优势互补。特别是结合弥散张量成像(DTI)等技术,可以同时探究结构连接和功能连接的耦合与失耦合,从而更全面地构建PSD的脑网络模型。
3. 探索治疗靶点与疗效监控:本研究发现的异常激活脑区(DLPFC, mPFC)和异常连接环路,为经颅磁刺激(TMS)、经颅直流电刺激(tDCS)等神经调控治疗提供了潜在的干预靶点。未来的研究可以利用fNIRS实时监测这些治疗手段对大脑功能和连接的调节效果,从而指导个体化治疗方案的制定。
综上所述,这篇研究为我们深入理解PSD的神经生物学机制打开了一扇新的窗口,它清晰地表明,PSD并非简单的“心情不好”,而是伴随着大脑额颞叶皮层深刻而复杂的功能重组。fNIRS作为一种客观、便捷的检测工具,在未来PSD的精准诊疗中必将扮演越来越重要的角色。
 0
0



